
¿ Un lápiz conduce la electricidad ?
|
|
En este experimento que hemos realizado esta vez, podemos ver cómo un lápiz nos puede echar un cable y no sólo a la hora de escribir sino que también nos puede servir como cable siempre y cuando esté en un medio en el que no haya oxígeno puesto que hace que el grafito del lápiz se prenda como el carbón que le ponemos a la barbacoa. |
Para la realización del experimento necesitamos los siguientes elementos y realizar los siguientes pasos:
1º - El primer paso es comprobar que el grafito del lápiz, el elemento negro con el que se escribe, se ve por los dos extremos del lápiz. Nosotros hemos hecho un pequeño orificio para que uno de los clips pueda estar en contacto permanente. Si crees conveniente tener un esquema del montaje del experimento y los pasos a seguir, puedes descargarte un archivo con las explicaciones en el siguiente enlace: Esquema para la realización del experimento: ¿ Un lápiz conduce la electricidad ? |
|


Principio de funcionamiento
¿No te parece increíble que algo que no es un metal conduzca la electricidad? Cuando yo me encontraba en la escuela nos enseñaron que los metales eran buenos conductores de electricidad y del calor, pero nunca nos explicaron por qué esto sucede así y que el resto de cosas no conducen la electricidad. Pues ¡cuál mi sorpresa!, cuando llegué a la universidad y en la clase de "Química" nos contaron que el grafito conducía la electricidad, algo que no es metálico conduce la electricidad. y no solo eso, sino también las sales ácidos y alcoholes disueltos en agua como se explica en el experimento: "Encender Una Bombilla Con Sal" . Pero aún en la universidad, seguían sin explicarme por qué los metales o el grafito conducen la electricidad. Pero investigando un poco al acabar la universidad y reorganizando los conocimientos adquiridos, encontré la respuesta.
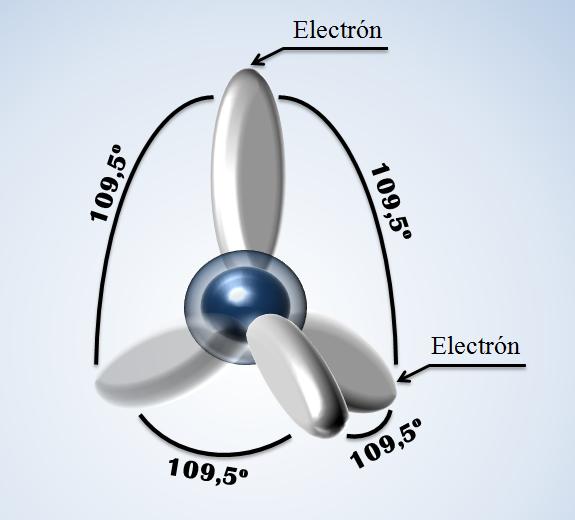 A los átomos de los elementos les gusta unirse de varias maneras y dependiendo de cómo se unan, se organizan y se colocan de una determinada manera. Pues bien, esta manera de unirse y de organizarse le proporcionan al material sus propiedades como la dureza del material que forman, lo frágil que es este material, su conductividad del calor y también la conductividad de la electricidad. Ya sé que hasta aquí no has entendido nada de lo que te estoy contando, y por ello te pido disculpas. Pero ahora viene lo bueno. Los átomos tienen dos partes: El núcleo y la corteza. En el núcleo se encuentran los protones en conjunto con los neutrones y en la corteza se encuentran los electrones. La corteza de los átomos está formada por los electrones que se agrupan en los niveles electrónicos. ¿Qué son estos niveles electrónicos? Pues para entenderlo de alguna manera, son como varios pisos donde circulan los electrones. Y a todos los átomos les gusta tener estos pisos llenos de inquilinos (2 u 8 inquilinos en el último piso preferiblemente y 8 como máximo), y si tienen pocos inquilinos en un piso les gusta echarlos del piso y cederle estos electrones a otros átomos que puedan completar sus pisos con los nuevos inquilinos cedidos. Esto quiere decir que a los átomos les gusta compartir sus electrones y por ello necesitan unirse con otros átomos para poder compartirlos. Como vemos en la imagen de la derecha el átomo de carbono tiene 4 electrones en el último nivel electrónico y por ello debería unirse con otros átomos para compartir 4 electrones más y así poder tener 8 electrones a su alrededor y cumplir la regla de los pisos completos (regla del octete).
A los átomos de los elementos les gusta unirse de varias maneras y dependiendo de cómo se unan, se organizan y se colocan de una determinada manera. Pues bien, esta manera de unirse y de organizarse le proporcionan al material sus propiedades como la dureza del material que forman, lo frágil que es este material, su conductividad del calor y también la conductividad de la electricidad. Ya sé que hasta aquí no has entendido nada de lo que te estoy contando, y por ello te pido disculpas. Pero ahora viene lo bueno. Los átomos tienen dos partes: El núcleo y la corteza. En el núcleo se encuentran los protones en conjunto con los neutrones y en la corteza se encuentran los electrones. La corteza de los átomos está formada por los electrones que se agrupan en los niveles electrónicos. ¿Qué son estos niveles electrónicos? Pues para entenderlo de alguna manera, son como varios pisos donde circulan los electrones. Y a todos los átomos les gusta tener estos pisos llenos de inquilinos (2 u 8 inquilinos en el último piso preferiblemente y 8 como máximo), y si tienen pocos inquilinos en un piso les gusta echarlos del piso y cederle estos electrones a otros átomos que puedan completar sus pisos con los nuevos inquilinos cedidos. Esto quiere decir que a los átomos les gusta compartir sus electrones y por ello necesitan unirse con otros átomos para poder compartirlos. Como vemos en la imagen de la derecha el átomo de carbono tiene 4 electrones en el último nivel electrónico y por ello debería unirse con otros átomos para compartir 4 electrones más y así poder tener 8 electrones a su alrededor y cumplir la regla de los pisos completos (regla del octete).
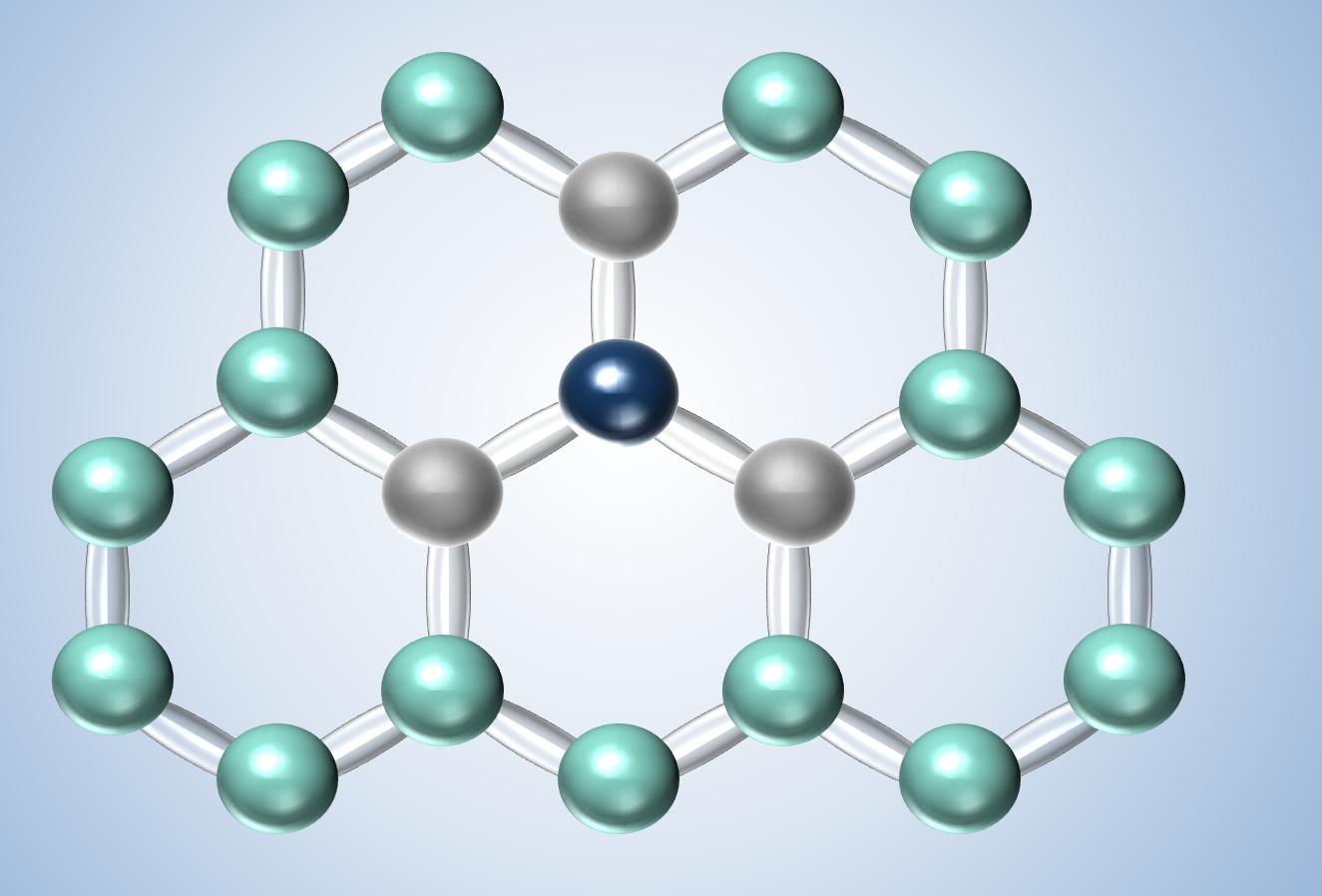 En el caso del grafito los átomos de carbono se unen con otros tres átomos al compartir sus electrones, que a su vez se unen con otros 2 átomos más, tal y como podemos ver en la imagen que aparece a la izquierda. En esta imagen podemos ver cómo estos átomos forman una red en forma de panal de abeja en un plano y esto es lo que conocemos como grafito. De esta forma se ve que el Carbono comparte 3 electrones, generando enlaces fuertes en un plano con 3 átomos de Carbono más. Pero el Carbono tiene 4 electrones en su último piso. ¿Qué es lo que pasa con el 4º electrón? Este electrón se queda como en el aire, intentando unirse a otro átomo de Carbono en otro plano, pero para poder unirse necesita acercarse más al átomo del plano que está en paralelo. Por eso, si se somete el grafito a muy altas presiones lo que obtenemos es diamante, que es lo mismo que el grafito pero con los 4 electrones compartidos generando uniones fuertes. Pero en el caso del grafito no llegan a unirse todos los electrones y al estar como en el aire, decimos que éste es un electrón libre. Esto quiere decir que si lo sometemos a un campo eléctrico este se puede mover, por eso si sometemos al grafito a un campo eléctrico como el que produce la pila de nuestro experimento los electrones de estos átomos se pueden mover a través de la red formada por los átomos de carbono.
En el caso del grafito los átomos de carbono se unen con otros tres átomos al compartir sus electrones, que a su vez se unen con otros 2 átomos más, tal y como podemos ver en la imagen que aparece a la izquierda. En esta imagen podemos ver cómo estos átomos forman una red en forma de panal de abeja en un plano y esto es lo que conocemos como grafito. De esta forma se ve que el Carbono comparte 3 electrones, generando enlaces fuertes en un plano con 3 átomos de Carbono más. Pero el Carbono tiene 4 electrones en su último piso. ¿Qué es lo que pasa con el 4º electrón? Este electrón se queda como en el aire, intentando unirse a otro átomo de Carbono en otro plano, pero para poder unirse necesita acercarse más al átomo del plano que está en paralelo. Por eso, si se somete el grafito a muy altas presiones lo que obtenemos es diamante, que es lo mismo que el grafito pero con los 4 electrones compartidos generando uniones fuertes. Pero en el caso del grafito no llegan a unirse todos los electrones y al estar como en el aire, decimos que éste es un electrón libre. Esto quiere decir que si lo sometemos a un campo eléctrico este se puede mover, por eso si sometemos al grafito a un campo eléctrico como el que produce la pila de nuestro experimento los electrones de estos átomos se pueden mover a través de la red formada por los átomos de carbono.
Por favor, indícanos si te ha resultado útil y te ha gustado el contenido de esta página:
¿Y ahora por qué los metales conducen la electricidad? Ahora sabemos por qué el grafito conduce la electricidad, pero no te has preguntado por qué los metales conducen la electricidad, ¿Será por la misma razón que el grafito conduce la electricidad? ¿O por qué será?
La razón la volvemos a encontrar en que a los átomos les gusta tener 2 u 8 electrones en los últimos niveles electrónicos, pero ahora lo que ocurre es que los metales tienen menos electrones de los que realmente necesitan para completar su nivel electrónico, por esto lo que pasa es que para poder cumplir con esta necesidad los electrones se pasan viajando de átomo en átomo, y así los metales comparten todos sus electrones generando una nube de electrones alrededor de todos los átomos y que al mismo tiempo están en continuo movimiento manteniendo a todos los átomos unidos. Incluso se podría decir que todos los átomos están unidos con todos los átomos porque todos los electrones de el último nivel electrónico están siendo compartidos por todos los átomos y como se pueden mover por toda la red de átomos, también son electrones libres, como el electrón que el carbono no puede compartir. Y de la misma manera, si sometemos estos electrones a una diferencia de potencial eléctrico los electrones que están en el metal se desplazarán hacia el lado positivo. Como cuando le conectamos una pila, los electrones que entran por el lado negativo de la pila empujan a los electrones del metal y estos electrones que se encuentran en el metal son absorbidos en el lado positivo de la pila.
De esta manera podemos ver que aunque la manera de unirse de los átomos no sea la misma, el resultado que obtenemos es muy similar puesto que es tener electrones libres en todo el material. En el carbono por no poder compartir un electrón de cada átomo y en el metal por compartir todos los posibles.
Para los más curiosos
Puesto que los átomos de carbono en el grafito se agrupan en planos, esta forma de agruparse le proporciona al grafito las propiedades eléctricas que hemos visto, pero también nos permite darle la forma que deseemos si ejercemos una presión relativamente baja. Por eso, se pueden fabricar lápices de forma sencilla y además de esto, poder darle la forma que deseemos. Al estar agrupado en capas (los planos de los que hablábamos antes), estas capas se pueden deslizar unas sobre otras, por eso podemos escribir o dibujar tan fácilmente con el lápiz, simplemente, al trazar la línea se van separando las capas del grafito del lápiz y se agarran al papel. Y por la misma razón podemos borrarlo con la goma con la misma facilidad, porque simplemente el grafito se adhiere al papel pero no se impregna en él como lo hace la tinta del bolígrafo o de la pluma. Así, al pasarle la goma de borrar lo que conseguimos es hacer que el grafito se adhiera a la goma de borrar y deje de estar adherido al papel; de la misma manera que si le pasamos la escoba al suelo de nuestro cuarto el polvo deja de estar en el suelo y pasa a estar en el recogedor. Y no sólo ésto, de la misma manera al separarse en capas, que se deslizan unas sobre otras, se puede emplear como lubricante. Y como tiene todas estas propiedades se emplea para multitud de procesos como por ejemplo para escobillas de contacto eléctrico de motores y generadores eléctricos, como contramolde (o herramienta) para hacer moldes de metal de alta precisión mediante procesos de electroerosión y como conexión eléctrica en chips microscópicos entre otras más.
Las grandes construcciones no se realizan repentinamente.
Toda gran obra conlleva un grado de demora.